- ÉTHERS-OXYDES
- ÉTHERS-OXYDESLe chauffage, vers 140 0C, d’un mélange d’alcool vini (éthanol) et d’huile de vitriol (acide sulfurique) avait permis aux chimistes du XVIIIe siècle l’isolement d’un liquide très volatil, d’odeur forte, auquel ils donnèrent d’abord le nom d’«éther sulfurique». Plus tard, ce composé fut désigné sous les noms d’«éther des pharmaciens», d’«éther ordinaire», d’oxyde d’éthyle et d’éthoxyéthane (officiellement). C’est, sinon le plus simple, du moins le plus important d’une série de composés résultant de l’élimination d’eau entre deux molécules d’alcools identiques ou différents: R 漣O 漣R ou R 漣O 漣R , désignés sous le nom d’éthers-oxydes, et, plus récemment, sous le nom d’éthers; le nom a été étendu à des composés provenant de l’élimination d’une molécule d’eau entre un phénol et un alcool, ou entre deux phénols, identiques ou différents:
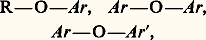 où Ar est le groupement aryle.Ce sont, en général, des liquides très stables thermiquement et chimiquement; plusieurs, dont l’oxyde d’éthyle, sont ainsi employés comme solvants d’extraction et solvants réactionnels. Ils jouent un rôle fondamental dans la préparation des composés organométalliques, en particulier des organomagnésiens. L’oxyde d’éthyle a été longtemps employé comme anesthésique.Les éthers-oxydes cycliques présentent des propriétés particulières, notamment les époxydes (cycles à trois sommets) très réactifs et les polyéthers cycliques (éthers-couronne) remarquables complexants des cations.Nomenclature et préparationsLes éthers-oxydes ou éthers dérivent de l’eau par remplacement des deux hydrogènes par deux groupements hydrocarbonés (aliphatiques, alicycliques, aromatiques). Ils peuvent être symétriques: R 漣O 漣R ou dissymétriques (mixtes): R 漣O 漣R . La nomenclature officielle désigne la fonction éther par le préfixe alcoxy- ou aryloxy- suivi du nom de la chaîne principale (la plus longue ou la plus ramifiée). Une nomenclature courante désigne les dérivés symétriques par le nom (di)alkyléther et les éthers mixtes par le nom éther d’alkyle et d’alkyle ; les éthers cycliques ont des noms particuliers dérivant de la nomenclature des hétérocycles.Les monoéthers simples sont relativement rares dans le règne végétal: les plus communs d’entre eux dérivent de l’anisole C6H5 漣O 漣CH3. Par contre, la fonction alcoxy (méthoxy 漣OCH3) est très répandue dans des molécules naturelles complexes telles que la lignine, les alcaloïdes et les glucides.Deux éthers aliphatiques symétriques, l’éther éthylique et l’éther butylique, sont préparés par déshydratation des alcools primaires correspondants, soit par H2S4 à 120 0C, soit en catalyse hétérogène (Al23, à 250 0C). Ce type de préparation est pratiquement limité aux seuls alcools primaires, par suite de la tendance des alcools secondaires et tertiaires à subir, en milieu acide et à chaud, une élimination conduisant à un alcène. Cette réaction peut également se produire avec les alcools primaires, mais à température supérieure à 140 0C.La méthode la plus générale pour obtenir des éthers est celle que Williamson a proposée en 1850, la réaction d’un alcoolate alcalin sur un halogénure d’alkyle ou d’aryle:
où Ar est le groupement aryle.Ce sont, en général, des liquides très stables thermiquement et chimiquement; plusieurs, dont l’oxyde d’éthyle, sont ainsi employés comme solvants d’extraction et solvants réactionnels. Ils jouent un rôle fondamental dans la préparation des composés organométalliques, en particulier des organomagnésiens. L’oxyde d’éthyle a été longtemps employé comme anesthésique.Les éthers-oxydes cycliques présentent des propriétés particulières, notamment les époxydes (cycles à trois sommets) très réactifs et les polyéthers cycliques (éthers-couronne) remarquables complexants des cations.Nomenclature et préparationsLes éthers-oxydes ou éthers dérivent de l’eau par remplacement des deux hydrogènes par deux groupements hydrocarbonés (aliphatiques, alicycliques, aromatiques). Ils peuvent être symétriques: R 漣O 漣R ou dissymétriques (mixtes): R 漣O 漣R . La nomenclature officielle désigne la fonction éther par le préfixe alcoxy- ou aryloxy- suivi du nom de la chaîne principale (la plus longue ou la plus ramifiée). Une nomenclature courante désigne les dérivés symétriques par le nom (di)alkyléther et les éthers mixtes par le nom éther d’alkyle et d’alkyle ; les éthers cycliques ont des noms particuliers dérivant de la nomenclature des hétérocycles.Les monoéthers simples sont relativement rares dans le règne végétal: les plus communs d’entre eux dérivent de l’anisole C6H5 漣O 漣CH3. Par contre, la fonction alcoxy (méthoxy 漣OCH3) est très répandue dans des molécules naturelles complexes telles que la lignine, les alcaloïdes et les glucides.Deux éthers aliphatiques symétriques, l’éther éthylique et l’éther butylique, sont préparés par déshydratation des alcools primaires correspondants, soit par H2S4 à 120 0C, soit en catalyse hétérogène (Al23, à 250 0C). Ce type de préparation est pratiquement limité aux seuls alcools primaires, par suite de la tendance des alcools secondaires et tertiaires à subir, en milieu acide et à chaud, une élimination conduisant à un alcène. Cette réaction peut également se produire avec les alcools primaires, mais à température supérieure à 140 0C.La méthode la plus générale pour obtenir des éthers est celle que Williamson a proposée en 1850, la réaction d’un alcoolate alcalin sur un halogénure d’alkyle ou d’aryle: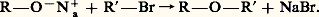 Bien que générale, cette préparation est pratiquement limitée aux halogénures primaires, les halogénures secondaires et surtout tertiaires étant susceptibles, dans les conditions de la réaction, de subir une déshydrohalogénation.Les éthers de tertiobutyle peuvent provenir, en catalyse acide, de l’addition d’un alcool ou d’un phénol sur l’isobutène.Les préparations des éthers cycliques sont le plus souvent dérivées de la méthode de Williamson: la même chaîne portant à la fois les fonctions alcoolate et halogénure. Les époxydes-1,2 (oxiranes) peuvent être obtenus par oxydation des alcènes. L’oxyde d’éthylène est préparé industriellement par oxydation de l’éthylène par l’oxygène en présence d’un catalyseur à l’argent. L’oxyde de propylène est fabriqué soit par déshydrochloration du chloro-1-propan-2-ol, soit, plus récemment, par oxydation du propylène par un hydroperoxyde, en présence d’un catalyseur au molybdène; quant aux éthers-couronne, leur préparation fait intervenir une suite de réactions.Structure et propriétés physiquesLa structure géométrique des éthers est assez proche de celles de l’eau et des alcools. L’atome d’oxygène (hybridation sp3) échange avec les deux groupes carbonés des liaisons 靖 dont l’angle est plus ouvert que dans le cas de l’eau ou des alcools par suite de la répulsion entre les deux groupes alkyle. La conformation de l’éther éthylique est très comparable à celle du n -pentane; celle du tétrahydrofurane (de masse moléculaire comparable) laisse un atome d’oxygène beaucoup plus dégagé et qui pourra donner lieu à des associations plus solides. Les températures d’ébullition des éthers sont légèrement supérieures à celles des alcanes de masse moléculaire voisine: l’éther méthylique est un gaz, ainsi que l’éther mixte de méthyle et d’éthyle; elles sont nettement inférieures à celles des alcools correspondants. Les premiers termes sont solubles dans l’eau: l’éther éthylique dissout 1,5 p. 100 d’eau et l’eau en dissout 7,5 p. 100. Ce sont d’excellents solvants qui, par leur fonction oxygénée, présentent une affinité pour les centres acides (électrophiles) et, par leur chaîne hydrocarbonée, manifestent une affinité lipophile.Du fait de sa volatilité (T éb = 35 0C), l’éther éthylique, dont la densité de vapeur (2,55 g . l-1) représente plus de deux fois celle de l’air, est un solvant dangereux: il a tendance à s’accumuler dans les parties basses du laboratoire et à provoquer des incendies lorsqu’il est au contact d’une flamme, ou même simplement d’un point chaud.Un autre danger des éthers légers utilisés comme solvants est leur facile oxydation à l’air, qui conduit à la formation d’hydroperoxydes (et de peroxydes) très instables et peu volatils, décelables et dosables par l’iodure de potassium qu’ils oxydent en iode. Ces éthers, dans cette utilisation, doivent être traités par des réducteurs, comme le sulfate ferreux, avant d’être distillés à sec. Le tétrahydrofurane (THF) est moins volatil que l’éther éthylique, il présente des propriétés de solvatation plus marquées (moindre gène stérique à la solvatation) et est miscible à l’eau avec laquelle il forme un azéotrope à 4,3 p. 100 d’eau.Propriétés chimiquesLa fonction éther est en elle-même peu réactive et la liaison C 漣O est relativement solide, n’étant susceptible d’ouverture qu’en présence d’un acide fort.Les éthers ne réagissent, à la température ordinaire, ni avec le sodium, ni avec les bases fortes: ils résistent à l’attaque des nucléophiles et, à ce titre, sont utilisés comme solvants dans des préparations mettant en œuvre ces réactifs, en particulier les organométalliques (solvants des organomagnésiens et organolithiens).Leurs propriétés basiques (pK a = 漣 3,5) se manifestent dans la formation de complexes (adduits) divers: le dioxane forme avec le brome un composé d’addition, le dibromure de dioxane, bien cristallisé, utilisé comme agent de bromation.En présence d’oxygène, les éthers possédant un hydrogène sur un carbone en 見 subissent, à la température ordinaire, une hydroperoxydation accélérée par la lumière. Cette réaction radicalaire est ralentie par addition de petites quantités d’antioxygènes (hydroquinone, amines aromatiques).Les réactions aboutissant à la rupture d’une liaison C 漣O se produisent, sous l’action des acides, d’autant plus facilement que le fragment carboné résultant est susceptible de former une carbocation plus stable (tertiaire, allylique, benzylique).Les acides halogénés attaquent les éthers en formant un halogénure d’alkyle et un alcool qui, si les proportions acide/éthers sont suffisantes, donne un second halogénure d’alkyle. Pour les dérivés primaires et secondaires, l’attaque est normalement S2 et c’est le groupe alkyle le moins substitué qui est transformé en halogénure; pour les éthers tertiaires ou allyliques et benzyliques, le mécanisme est S1 et c’est l’halogénure correspondant au carbocation la plus stable qui se forme.Dans le dosage des fonctions méthoxy (et éthoxy) selon Zeisel, la molécule d’éther est traitée à l’ébullition par de l’acide iodhydrique concentré; l’iodure de méthyle formé (T éb = 42,3 0C) est distillé dans une solution de nitrate d’argent et le précipité d’iodure d’argent formé est pesé.Les éthers sont de même scindés par les chlorures d’acides en présence de ZnCl2, selon un mécanisme analogue.Éthers-oxydes cycliquesParmi les éthers-oxydes cycliques, les époxydes-1,2 (oxiranes) jouent un rôle important en raison de leur structure électronique particulière: le système des liaisons 靖 du cycle à trois sommets possède un certain caractère 神.Les époxydes sont préparés en laboratoire par action des peracides sur les alcènes ou par action d’une base forte sur les alcools 見-chlorés (chlorhydrines de glycol), eux-mêmes obtenus par addition de l’acide hypochloreux sur un alcène.Comme les éthers acycliques, les époxydes réagissent, en milieu acide, avec des réactifs nucléophiles, mais la réaction est beaucoup plus facile par suite de la diminution de contrainte qui résulte de l’ouverture du cycle. L’eau s’additionne en formant le glycol. Ce dernier, à son tour, forme avec l’oxyde d’éthylène le diéthylèneglycol (monoétherdiol), qui peut également s’additionner à l’oxyde d’éthylène en donnant le triéthylèneglycol (diétherdiol), et ainsi de suite. Pour obtenir le monoéthylèneglycol, on met en réaction l’oxyde d’éthylène avec un grand excès d’eau. Le glycol est utilisé comme antigel et comme dialcool pour la fabrication de polyesters tels que les films et les fibres textiles. Les polyéthylèneglycols, obtenus avec un excès d’oxyde d’éthylène, sont des composés liquides dont la viscosité augmente avec le poids moléculaire. Les plus lourds ont la consistance de cires; ils sont solubles dans l’eau et servent de base pour la fabrication de tensio-actifs non ioniques.L’oxyde d’éthylène réagit avec les solutions aqueuses d’ammoniaque en donnant un mélange des trois éthanolamines. Ces produits sont des bases faibles, utilisées pour la purification industrielle des gaz par élimination des constituants acides (CO2, H2S); elles sont également utilisées pour la fabrication de détergents par réaction avec des acides gras (mélanges d’esters et d’amides).L’oxyde d’éthylène est également utilisé pour greffer, sur des composés à fonction acide, des groupements polyoxyéthyle, qui modifient leurs propriétés en leur conférant un caractère hydrophile. Les principaux dérivés polyéthoxylés résultent de sa réaction sur les alkylphénols, les alcools gras, les acides gras et les amines grasses.L’oxyde de propylène, par hydratation en milieu acide, conduit aux polypropylèneglycols, constituants de base pour la production des polyuréthannes.
Bien que générale, cette préparation est pratiquement limitée aux halogénures primaires, les halogénures secondaires et surtout tertiaires étant susceptibles, dans les conditions de la réaction, de subir une déshydrohalogénation.Les éthers de tertiobutyle peuvent provenir, en catalyse acide, de l’addition d’un alcool ou d’un phénol sur l’isobutène.Les préparations des éthers cycliques sont le plus souvent dérivées de la méthode de Williamson: la même chaîne portant à la fois les fonctions alcoolate et halogénure. Les époxydes-1,2 (oxiranes) peuvent être obtenus par oxydation des alcènes. L’oxyde d’éthylène est préparé industriellement par oxydation de l’éthylène par l’oxygène en présence d’un catalyseur à l’argent. L’oxyde de propylène est fabriqué soit par déshydrochloration du chloro-1-propan-2-ol, soit, plus récemment, par oxydation du propylène par un hydroperoxyde, en présence d’un catalyseur au molybdène; quant aux éthers-couronne, leur préparation fait intervenir une suite de réactions.Structure et propriétés physiquesLa structure géométrique des éthers est assez proche de celles de l’eau et des alcools. L’atome d’oxygène (hybridation sp3) échange avec les deux groupes carbonés des liaisons 靖 dont l’angle est plus ouvert que dans le cas de l’eau ou des alcools par suite de la répulsion entre les deux groupes alkyle. La conformation de l’éther éthylique est très comparable à celle du n -pentane; celle du tétrahydrofurane (de masse moléculaire comparable) laisse un atome d’oxygène beaucoup plus dégagé et qui pourra donner lieu à des associations plus solides. Les températures d’ébullition des éthers sont légèrement supérieures à celles des alcanes de masse moléculaire voisine: l’éther méthylique est un gaz, ainsi que l’éther mixte de méthyle et d’éthyle; elles sont nettement inférieures à celles des alcools correspondants. Les premiers termes sont solubles dans l’eau: l’éther éthylique dissout 1,5 p. 100 d’eau et l’eau en dissout 7,5 p. 100. Ce sont d’excellents solvants qui, par leur fonction oxygénée, présentent une affinité pour les centres acides (électrophiles) et, par leur chaîne hydrocarbonée, manifestent une affinité lipophile.Du fait de sa volatilité (T éb = 35 0C), l’éther éthylique, dont la densité de vapeur (2,55 g . l-1) représente plus de deux fois celle de l’air, est un solvant dangereux: il a tendance à s’accumuler dans les parties basses du laboratoire et à provoquer des incendies lorsqu’il est au contact d’une flamme, ou même simplement d’un point chaud.Un autre danger des éthers légers utilisés comme solvants est leur facile oxydation à l’air, qui conduit à la formation d’hydroperoxydes (et de peroxydes) très instables et peu volatils, décelables et dosables par l’iodure de potassium qu’ils oxydent en iode. Ces éthers, dans cette utilisation, doivent être traités par des réducteurs, comme le sulfate ferreux, avant d’être distillés à sec. Le tétrahydrofurane (THF) est moins volatil que l’éther éthylique, il présente des propriétés de solvatation plus marquées (moindre gène stérique à la solvatation) et est miscible à l’eau avec laquelle il forme un azéotrope à 4,3 p. 100 d’eau.Propriétés chimiquesLa fonction éther est en elle-même peu réactive et la liaison C 漣O est relativement solide, n’étant susceptible d’ouverture qu’en présence d’un acide fort.Les éthers ne réagissent, à la température ordinaire, ni avec le sodium, ni avec les bases fortes: ils résistent à l’attaque des nucléophiles et, à ce titre, sont utilisés comme solvants dans des préparations mettant en œuvre ces réactifs, en particulier les organométalliques (solvants des organomagnésiens et organolithiens).Leurs propriétés basiques (pK a = 漣 3,5) se manifestent dans la formation de complexes (adduits) divers: le dioxane forme avec le brome un composé d’addition, le dibromure de dioxane, bien cristallisé, utilisé comme agent de bromation.En présence d’oxygène, les éthers possédant un hydrogène sur un carbone en 見 subissent, à la température ordinaire, une hydroperoxydation accélérée par la lumière. Cette réaction radicalaire est ralentie par addition de petites quantités d’antioxygènes (hydroquinone, amines aromatiques).Les réactions aboutissant à la rupture d’une liaison C 漣O se produisent, sous l’action des acides, d’autant plus facilement que le fragment carboné résultant est susceptible de former une carbocation plus stable (tertiaire, allylique, benzylique).Les acides halogénés attaquent les éthers en formant un halogénure d’alkyle et un alcool qui, si les proportions acide/éthers sont suffisantes, donne un second halogénure d’alkyle. Pour les dérivés primaires et secondaires, l’attaque est normalement S2 et c’est le groupe alkyle le moins substitué qui est transformé en halogénure; pour les éthers tertiaires ou allyliques et benzyliques, le mécanisme est S1 et c’est l’halogénure correspondant au carbocation la plus stable qui se forme.Dans le dosage des fonctions méthoxy (et éthoxy) selon Zeisel, la molécule d’éther est traitée à l’ébullition par de l’acide iodhydrique concentré; l’iodure de méthyle formé (T éb = 42,3 0C) est distillé dans une solution de nitrate d’argent et le précipité d’iodure d’argent formé est pesé.Les éthers sont de même scindés par les chlorures d’acides en présence de ZnCl2, selon un mécanisme analogue.Éthers-oxydes cycliquesParmi les éthers-oxydes cycliques, les époxydes-1,2 (oxiranes) jouent un rôle important en raison de leur structure électronique particulière: le système des liaisons 靖 du cycle à trois sommets possède un certain caractère 神.Les époxydes sont préparés en laboratoire par action des peracides sur les alcènes ou par action d’une base forte sur les alcools 見-chlorés (chlorhydrines de glycol), eux-mêmes obtenus par addition de l’acide hypochloreux sur un alcène.Comme les éthers acycliques, les époxydes réagissent, en milieu acide, avec des réactifs nucléophiles, mais la réaction est beaucoup plus facile par suite de la diminution de contrainte qui résulte de l’ouverture du cycle. L’eau s’additionne en formant le glycol. Ce dernier, à son tour, forme avec l’oxyde d’éthylène le diéthylèneglycol (monoétherdiol), qui peut également s’additionner à l’oxyde d’éthylène en donnant le triéthylèneglycol (diétherdiol), et ainsi de suite. Pour obtenir le monoéthylèneglycol, on met en réaction l’oxyde d’éthylène avec un grand excès d’eau. Le glycol est utilisé comme antigel et comme dialcool pour la fabrication de polyesters tels que les films et les fibres textiles. Les polyéthylèneglycols, obtenus avec un excès d’oxyde d’éthylène, sont des composés liquides dont la viscosité augmente avec le poids moléculaire. Les plus lourds ont la consistance de cires; ils sont solubles dans l’eau et servent de base pour la fabrication de tensio-actifs non ioniques.L’oxyde d’éthylène réagit avec les solutions aqueuses d’ammoniaque en donnant un mélange des trois éthanolamines. Ces produits sont des bases faibles, utilisées pour la purification industrielle des gaz par élimination des constituants acides (CO2, H2S); elles sont également utilisées pour la fabrication de détergents par réaction avec des acides gras (mélanges d’esters et d’amides).L’oxyde d’éthylène est également utilisé pour greffer, sur des composés à fonction acide, des groupements polyoxyéthyle, qui modifient leurs propriétés en leur conférant un caractère hydrophile. Les principaux dérivés polyéthoxylés résultent de sa réaction sur les alkylphénols, les alcools gras, les acides gras et les amines grasses.L’oxyde de propylène, par hydratation en milieu acide, conduit aux polypropylèneglycols, constituants de base pour la production des polyuréthannes.
Encyclopédie Universelle. 2012.
